今回のテーマはフルミスト点鼻液!なんと、点鼻型のインフルエンザワクチンです。

・フルミストはどのような特徴があるのか?
・従来の注射型インフルエンザHAワクチンと何が違うのか?
押さえておきたいポイントをまとめたので共有します。
インフルエンザワクチンの一覧表
国内で承認されているインフルエンザワクチンは3種類(フルミスト、インフルエンザHAワクチン、フルービックHA)、6製品(各社)です。
| フルミスト点鼻液 | インフルエンザHAワクチン | フルービックHA | ||
|---|---|---|---|---|
| 製剤写真 | 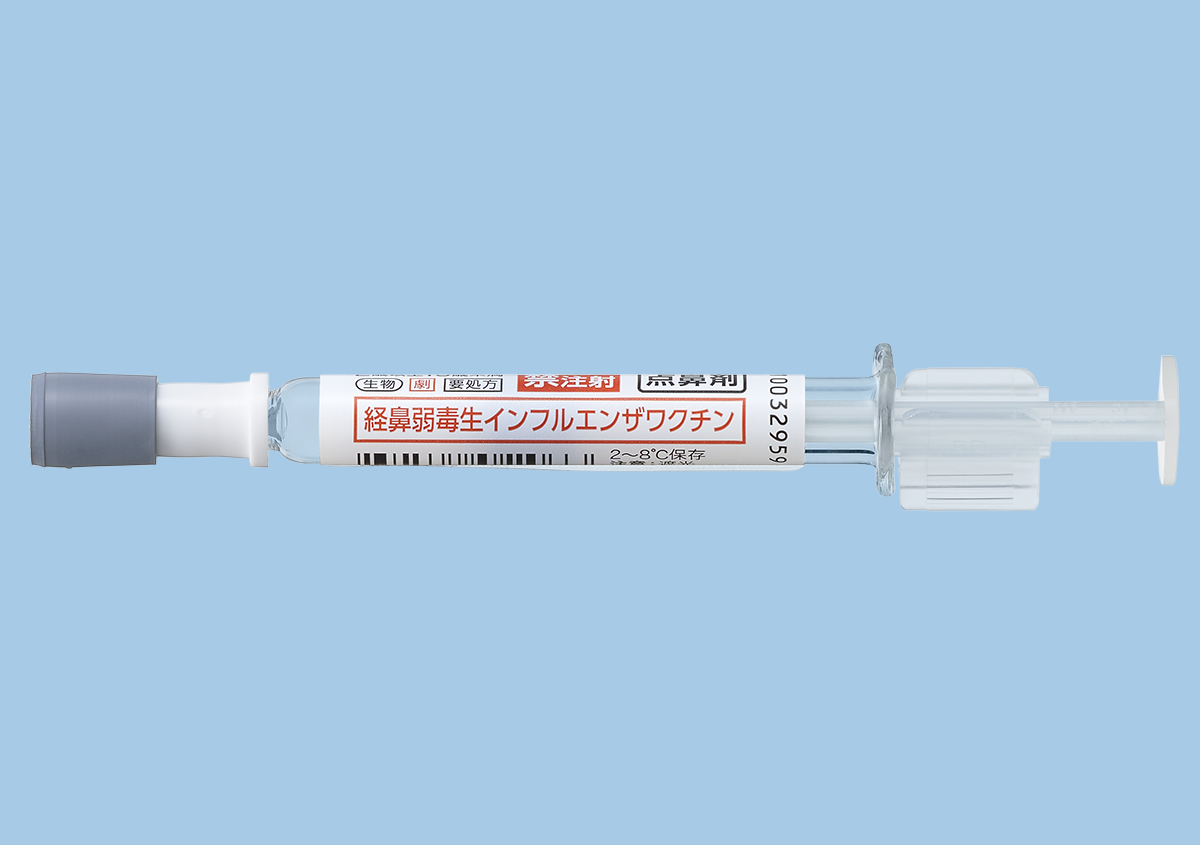  |   |   |   |
| 製造販売 | ①第一三共 | ②微研、③KMB、④デンカ | ⑤微研 | ⑥微研 |
| 剤型 | 点鼻液 | 注射(バイアル) | 注射(シリンジ) | |
| 種類 | 弱毒生ワクチン | 不活化ワクチン | ||
| 投与経路 | 鼻腔内 | 皮下 | ||
| 製造株 | A型株:ノルウェー/31694/2022(H1N1)、パース/722/2024(H3N2) B型株:オーストリア/1359417/2021(ビクトリア系統) | A型株:ビクトリア/4897/2022(H1N1)、パース/722/2024(H3N2) B型株;オーストリア/1359417/2021(ビクトリア系統) | ||
| 有効成分 | 0.2mL中、弱毒生インフルエンザウイルス(A型・B型) | インフルエンザウイルス(A型・B型)のHA画分 | ||
| 添加物 | 精製ゼラチン、L-アルギニン塩酸塩、L-グルタミン酸ナトリウム、精製白糖、リン酸二カリウム、リン酸二水素カリウム、pH調節剤 | リン酸水素ナトリウム水和物、リン酸二水素ナトリウム水和物、塩化ナトリウム 、チメロサール、ホルマリン 微研はホルマリン非含有 | リン酸水素ナトリウム水和物、リン酸二水素ナトリウム水和物、塩化ナトリウム | |
| 適応 | インフルエンザの予防 | |||
| 対象者 | 2歳以上19歳未満 | 6ヶ月以上 | 6ヶ月以上 ※シリンジは3歳未満に使用不可 | |
| 用法用量 | 0.2mLを1回(各鼻腔内に0.1mLを1噴霧)、鼻腔内に噴霧 | 6ヶ月以上3歳未満 0.25mL 3歳以上13歳未満 0.5mL 2~4週間の間隔をおいて2回注射 13歳以上 0.5mL 1回又はおよそ1~4週間の間隔をおいて2回注射 | 3歳以上13歳未満 0.5mL 2~4週間の間隔をおいて2回注射 13歳以上 0.5mL 1回又はおよそ1~4週間の間隔をおいて2回注射 | |
基本情報をまとめると、ざっと上記の通りです。ここからは、フルミスト点鼻液の特徴を注射型インフルエンザHAワクチンと比較しながら見ていきましょう。ポイントは全部で11個です。
- 分類
- 作用機序
- 投与経路
- 価数
- 適応
- 対象者
- 投与回数
- 相互作用
- 添加物
- 臨床の位置付け
- 廃棄方法
2025年1月、高用量のインフルエンザHAワクチン「エフルエルダ筋注」が承認されました。別記事にまとめていますので合わせてご覧頂けたらと幸いです!

フルミスト点鼻液の分類
| フルミスト | インフルエンザHAワクチン | |
|---|---|---|
| 分類 | 弱毒生ワクチン | 不活化ワクチン |
| 製法 | 弱毒生インフルエンザウイルス(A型及びB型株)をそれぞれ個別にSPF発育鶏卵の尿膜腔内に接種して培養し、増殖したウイルスを含む尿膜腔液をとり、ゾーナル遠心機を用いたショ糖密度勾配遠心法による精製濃縮・希釈・無菌ろ過を経て、濃縮ゼラチン-アルギニン-グルタミン酸緩衝液及びショ糖リン酸緩衝液を用いて各株ウイルスが規定量含まれるよう希釈調整した液剤 | インフルエンザウイルスのA型及びB型株をそれぞれ個別に発育鶏卵で培養し、増殖したウイルスを含む尿膜腔液をゾーナル遠心機によるしょ糖密度勾配遠心法により濃縮精製後、ウイルス粒子をエーテル等により処理して不活化したヘムアグルチニン(HA)画分浮遊液とし、ホルマリンで安定化した後、リン酸塩緩衝塩化ナトリウム液を用いて規定濃度に混合調製した液剤 |
| 有効成分 | ウイルスそのもの 弱毒生インフルエンザウイルス (A型・B型) | 膜タンパク質 インフルエンザウイルスのHA画分 (A型・B型) |
①フルミスト点鼻液は生ワクチンです。弱毒化したインフルエンザウイルスを鶏卵を用いて培養し、複数の生成工程(難しくて、よく分からない^_^)を経て、AとB型株のウイルスが規定量、含まれた液剤を生成します。一方で、②インフルエンザHAワクチンは不活化ワクチンです。鶏卵で培養したウイルスから、膜表面にあるヘムアグルチニン(HA)を分離し、AとB型株のウイルスのHA画分を規定量含む液剤を調製します。



ウイルスそのものか、ウイルス膜のタンパク質(HA)を接種するかの違いですね。
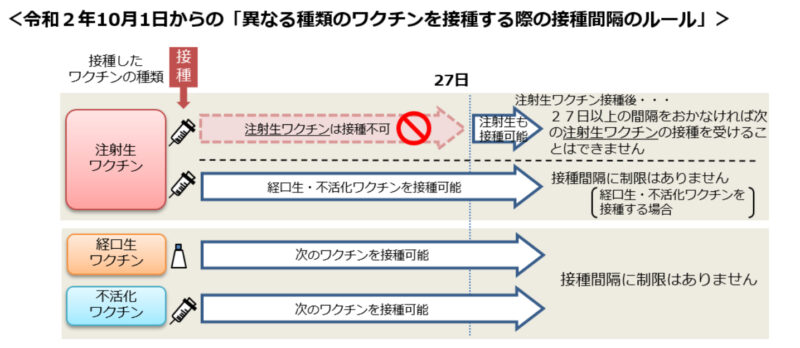
他のワクチンとの接種間隔は?
厚生労働省の基準は以下のとおりです。フルミストは点鼻型の生ワクチンであり、新剤型のため現時点で記載がありません。電子添文にも特に記載がなく、どのように対応すれば良いのか?審議結果報告書には、「麻疹ワクチン、おたふくかぜワクチン、風しんワクチン、水痘ワクチンとの同時接種は、安全性上の特段の懸念は認められていない」とあります。注射生ワクチンと27日以上の間隔が不要であることから、経口生ワクチンに準じた対応という理解ですかね。

フルミスト点鼻液の作用機序
| フルミスト | インフルエンザHAワクチン | |
|---|---|---|
| 作用機序 | このワクチンの接種は、抗原特異的血清中抗体及び粘膜抗体応答、並びに抗原特異的T細胞応答を誘導し、インフルエンザの予防に寄与すると考えられる。 | ヘムアグルチニンは、インフルエンザウイルスの表面抗原の一つであり、ウイルスの宿主細胞への吸着に関与している。本剤の接種により、ヘムアグルチニンに対する抗体が産生され、インフルエンザウイルスの防御抗体として働くことで、インフルエンザの予防が期待される |
| 抗体産生 | ||
| 細胞性免疫 | ||
| 粘膜抗体産生 |



フルミスト点鼻液は接種後ウイルスが体内で増殖し、自然感染に近い免疫反応を引き起こすため、抗体産生による液性免疫に加えて、細胞性免疫の誘導も期待されます。さらに、点鼻型であり、鼻粘膜局所の免疫も誘導されるのも注射型インフルエンザワクチンと異なる点ですね。
フルミスト点鼻液の投与経路
| フルミスト | インフルエンザHAワクチン | |
|---|---|---|
| 投与経路 | 点鼻 | 皮下 |
①フルミストは点鼻型のワクチンです。1回の薬液が充填されたプレフィルドシリンジを用いて、左右の鼻腔に注入します。注射型のように穿刺による痛みを伴わないことから、特に小児には有用です。
フルミスト点鼻液、経鼻投与のメリット
- 針の穿刺による疼痛や恐怖心がない
- 注射部位反応(紅斑、腫脹等)もない
- 針刺し事故のリスクもない
一方で、②インフルエンザHAワクチンはいずれも注射タイプです。バイアルから必要量をシリンジに抜き取って、皮下に投与します。フルービックHAはプレフィルドシリンジ製剤が用意されており、調製の手間がかからないのが利点ですね。



フルミストは点鼻型の製剤であり、安全で簡便に投与できるのは患者さんはもちろん、医療者にも有用だといえます。ただし、間違って注射しないようにしなければなりません(針が接続できないはず?)
フルミスト点鼻液は「禁注射!」
接種部位
本剤は鼻腔内噴霧用であり、絶対に注射しないこと。
フルミスト点鼻液 電子添文
フルミスト点鼻液の価数
| フルミスト | インフルエンザHAワクチン | |
|---|---|---|
| 価数 | 3価 | 3価 |
| A型 | H1N1 ノルウェー/31694/2022 H3N2 パース/722/2024 | H1N1 ビクトリア/4897/2022 H3N2 パース/722/2024 |
| B型 | ビクトリア系統 オーストリア/1359417/2021 | ビクトリア系統 オーストリア/1359417/2021 |
①フルミスト点鼻液は3価のワクチンです。インフルエンザA型2株とB型1株からなります。令和7年度
(2025/26シーズン)からA型H3N2はタイからパースに変更されました。
②インフルエンザHAワクチンは3価です。インフルエンザA型2株とB型1株で構成されています。昨シーズンは4価(B型が2株)でしたが、令和7年度(2025/26シーズン)から変更されました。フルミストとの違いは、A型H1N1の系統の違いですね。
- 国内のインフルエンザHAワクチン、去年との違いは?
-
令和5年度
(2023/24シーズン)令和6年度
(2024/25シーズン)令和7年度
(2025/26シーズン)変更の有無 A型H1N1 Victoria/4897/2022 左に同じ 左に同じ なし A型H3N2 Darwin/9/2021 California/122/2022 Perth/722/2024 あり B型ビクトリア Austria/1359417/2021 左に同じ 左に同じ なし B型山形 Phuket/3073/2013 左に同じ 非含有 あり 各製剤、電子添文より作成



フルミスト点鼻液は価数が少なくて大丈夫なのか?というと、2020年3月以降、自然界の流行で解析された山形系統ウイルスの報告はない状況であり、有効性に対する影響は問題ないと考えられています。
インフルエンザウイルスの分類について
- 血清型の違い
(A型、B型、C型、D型) - 抗原性の違い
(H1からH18、N1からN11)
インフルエンザウイルスは血清型により4つタイプに分類される
感染するのはA型とB型、C型
表面に存在する赤血球凝集素(ヘムアグルチニン Hemagglutinin:HA)
とノイラミニダーゼ(Neuraminidase:NA)の組み合わせにより、亜型に分類される
フルミスト点鼻液の適応
ここは共通ですね。
フルミスト点鼻液、インフルエンザHAワクチンの適応はインフルエンザの予防です。
フルミストの有効性
国内第3相臨床試験
- 対象…2歳以上19歳未満の健康小児910例
- 方法…フルミスト0.2mL(各鼻腔に0.1mL)を1回接種
- 比較…プラセボ0.2mL(各鼻腔に0.1mL)を1回接種
結果は以下のとおり
抗原性を問わないすべての分離株によるインフルエンザ発症割合(主要評価項目)
治験薬接種 14 日以内に発症したものを除く。
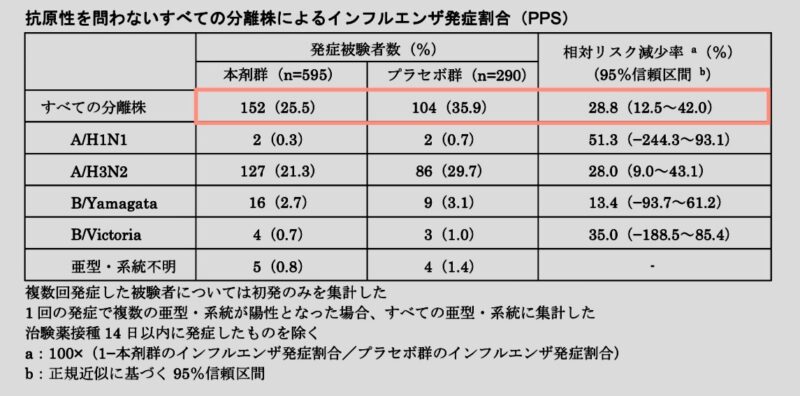

フルミストのプラセボ群に対する相対リスク減少率は28.8%でした。
抗原性一致株によるインフルエンザ発症割合(副次評価項目)
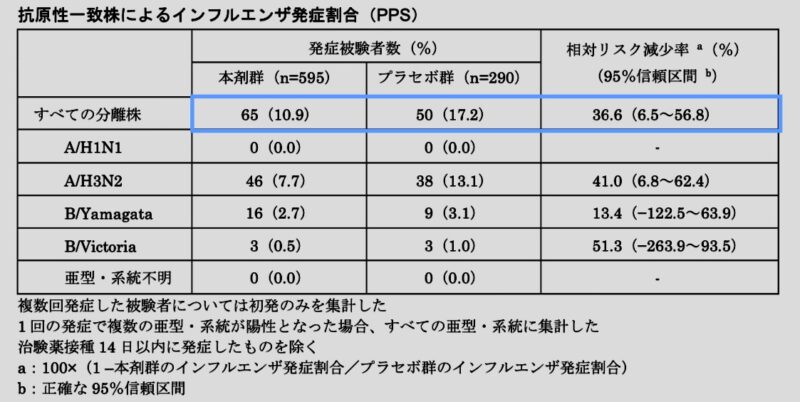

フルミストのプラセボ群に対する相対リスク減少率は36.6%でした。



フルミスト点鼻液は注射型インフルエンザHAワクチンよりも有効性が高いのか?現時点で予防効果について、明確な優位性を示す報告はありません。
不活化インフルエンザ HA ワクチン (正式名称:インフルエンザ HA ワクチン) (inactivated influenza vaccine:IIV)と経鼻弱毒生インフルエンザワクチン (live attenuated influenza vaccine:LAIV)の間にインフルエンザ罹患予防効果に対する明確な優位性は確認されていません。
経鼻弱毒生インフルエンザワクチンの使用に関する考え方 日本小児科学会予防接種・感染症対策委員会
フルミスト点鼻液の対象者
| フルミスト | インフルエンザHAワクチン | |
|---|---|---|
| 対象者 | 2歳以上19歳未満 | 6ヶ月以上 |
ポイントは2つです。①フルミスト点鼻液の対象者は2〜18歳の方に限定されています。同年齢を対象とした国内臨床試験において有効性と安全性が確認されているからです。参考までに、米国では2〜49歳の方は適応であり、日本とは対象年齢が異なります。一方で、インフルエンザHAワクチンの対象は6か月以上です。フルミストよりも広い年齢層に使用できます。
②フルミスト点鼻液は2歳未満の方に使用できません。海外臨床試験で接種後に入院、喘鳴のリスクが増加したとの報告があるためです。国内臨床試験では2歳未満は除外されています。
9.7 小児等 2歳未満の小児等に対しては本剤を接種しないこと。本剤は2歳未満の小児等に対する適応はなく、海外での臨床試験において、本剤接種後に2歳未満での入院及び喘鳴のリスクが増大したとの報告がある。
フルミスト点鼻液 電子添文



フルミスト点鼻液は対象者が限定的です。
・2歳以上の幼児
・小児(7〜14歳)
・若年者(15〜18歳)
フルミスト点鼻液の投与回数
| フルミスト | インフルエンザHAワクチン フルービックHA | |
|---|---|---|
| 投与回数 | 1回 2〜18歳 | 2回 6ヶ月〜12歳 |
| 1回 または 2回 13歳以上 |
①フルミスト点鼻液は1回接種です。米国でも1回接種が基本で、「インフルエンザワクチンの接種歴のない2〜8歳の小児のみ」2回接種が推奨されています。一方で、②インフルエンザHAワクチンは年齢に応じて1〜2回接種です。12歳以下の小児は2回接種が基本になります。



フルミスト点鼻液は、2回接種が必要なインフルエンザHAワクチン(13歳未満)と比べて、お子さんや保護者の通院回数が減り、医療者の負担も軽減されます。
フルミスト点鼻液の相互作用
| フルミスト | インフルエンザHAワクチン | |
|---|---|---|
| 併用禁忌 | 副腎皮質ホルモン剤(経口剤、注射剤)プレドニゾロン等、免疫抑制剤(経口剤、注射剤)、シクロスポリン(サンディミュン、ネオーラル)、タクロリムス(プログラフ)、アザチオプリン(イムラン) インフルエンザ様症状があらわれるおそれがある。 | |
| 併用注意 | 抗インフルエンザウイルス剤(オセルタミビルリン酸塩、ザナミビル水和物、ラニナミビルオクタン酸エステル水和物等) 本剤の効果が得られないおそれがある。 | 免疫抑制剤等 シクロスポリン等 本剤の効果が得られないおそれがある。 |
| サリチル酸系医薬品(アスピリン、サリチル酸ナトリウム等)、ジクロフェナクナトリウム、メフェナム酸 ライ症候群があらわれるおそれがある。 |
ポイントは2つです。①フルミスト点鼻液はステロイド等の免疫抑制剤と併用できません。生ワクチンであり、免疫抑制の状態では、ワクチンウイルスの感染増強、持続化の可能性があるからです。インフルエンザ様症状を引き起こす可能性が高まります。一方で、インフルエンザHAワクチンは免疫製剤と併用可能(併用注意)です。
特に長期あるいは大量投与を受けている者、又は投与中止後6か月以内の者は、免疫機能抑制下にあるため、ワクチンウイルスの感染を増強あるいは持続させる可能性がある。
フルミスト点鼻液、併用禁忌、機序・危険因子
また、②フルミストは抗インフルエンザ薬との併用も避ける必要があります。ノイラミニダーゼ阻害剤の作用により、ウイルスが体内で増殖できず、免疫誘導の妨げになるからです。十分な効果が得られない可能性があります。一方で、インフルエンザHAワクチンは併用可能です。



フルミスト点鼻液は生ワクチンであり、安全性や有効性の観点から、併用薬に対する確認も必要ですね。
フルミスト点鼻液の添加物
| フルミスト点鼻液 | インフルエンザHAワクチン | フルービックHA | |
|---|---|---|---|
| 添加物 | 精製ゼラチン、L-アルギニン塩酸塩、L-グルタミン酸ナトリウム、精製白糖、リン酸二カリウム、リン酸二水素カリウム、pH調節剤 | リン酸水素ナトリウム水和物、リン酸二水素ナトリウム水和物、塩化ナトリウム 、チメロサール | リン酸水素ナトリウム水和物、リン酸二水素ナトリウム水和物、塩化ナトリウム |
| ゼラチン | 含有あり アレルギー注意! | ||
| チメロサール | 含有あり アレルギー注意 |
①フルミスト点鼻液は接種前にゼラチンアレルギーの確認が欠かせません。安定剤として精製ゼラチンを含んでおり、アナフィラキシーを引き起こす可能性があるからです。投与の可否を慎重に判断し、接種後は十分な経過観察が必要になります。
本剤は安定剤として精製ゼラチンを含有している。ゼラチン含有製剤の接種により、ショック、アナフィラキシー(蕁麻疹、呼吸困難、血管性浮腫等)があらわれたとの報告があるので、問診を十分に行い、接種後は観察を十分に行うこと。
フルミスト点鼻液 電子添文
②インフルエンザHAワクチンはチメロサールに対するアレルギーの確認が必要です。添加剤としてチメロサール(水銀化合物)を含有しており、過敏症(発熱、発疹、蕁麻疹、紅斑、そう痒等)を引き起こす可能性があります。
本剤は添加剤としてチメロサール(水銀化合物)を含有している。チメロサール含有製剤の投与(接種)により、過敏症(発熱、発疹、蕁麻疹、紅斑、そう痒等)があらわれたとの報告があるので、問診を十分に行い、接種後は観察を十分に行うこと。
インフルエンザHAワクチン 電子添文
- インフルエンザHAワクチン
- ビームゲン注(B型肝炎ワクチン)
- 沈降破傷風トキソイド「生研」
一方で、③フルービックHAはチメロサールフリーのワクチンです。アレルギーがある方への選択肢として有用ですね。



インフルエンザワクチンは鶏卵を用いて培養しており、「鶏卵、鶏肉、その他鶏由来のものに対してアレルギーを呈するおそれのある者」は接種要注意者に該当します。加えて、添加物の種類によっても、アレルギーの確認が必要な点は押さえておきたいですね。
フルミスト点鼻液、臨床の位置付け
日本小児科学会の指針によると
・2歳から18歳
フルミストとインフルエンザHAワクチン(同様に推奨)
・フルミストを避けるべきケース(喘息患者、2歳未満と19歳以上、免疫不全患者、無脾症患者、妊婦、ミトコンドリア脳筋症患者、ゼラチンアレルギーを有する患者、中枢神経系の解剖学的バリアー破綻がある患者)
点鼻型のメリットを考えると、フルミスト一択ですよね。一方で、生ワクチンの特性や安全性、添加物等からインフルエンザHAワクチンの選択が望ましいケースもあります。
あと、授乳婦や周囲に免疫不全患者がいる場合もインフルエンザHAワクチンが推奨されています。フルミストはウイルスの水平伝播のリスクがあるからです。ワクチンウイルスは弱毒化されているもののの、免疫力が低下した人には感染症を引き起こす可能性があります。
本剤は弱毒生インフルエンザワクチンであり、飛沫又は接触によりワクチンウイルスの水平伝播の可能性があるため、ワクチン接種後1~2週間は、重度の免疫不全者との密接な関係を可能な限り避けるなど、必要な措置を講じることを被接種者又はその保護者に説明すること。
フルミスト点鼻液 重要な基本的注意
授乳婦、治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤は水平伝播の可能性があるため、ワクチン接種後1~2週間は乳児との接触を可能な限り控えること
フルミスト点鼻液 特定の背景を有する者に関する注意
フルミスト点鼻液の廃棄方法
| フルミスト | インフルエンザHAワクチン | フルービックHA | |
|---|---|---|---|
| 感染性廃棄物 | 生ワクチン | ||
| 非感染性廃棄物 | 不活化ワクチン | 不活化ワクチン |
①フルミスト点鼻液は弱毒生ワクチンであり、残液の感染性に注意が必要です。院内のマニュアルに従い、他の廃棄物と分別し、感染性廃棄物として適切に廃棄を行わなければなりません。
使用済みの外筒等は、感染性廃棄物として廃棄してください
フルミスト点鼻液 インタビューフォーム
一方で、②不活化ワクチンであるインフルエンザHAワクチンは感染性はなく、非感染性廃棄物として扱います。
ただし、インフルエンザHAワクチンにおいても、破損したバイアル(鋭利なもの)やシリンジ製剤(血液の逆流)は感染性廃棄物としての扱いです。
使用後のインフルエンザHAワクチンのバイアルは、破損などにより鋭利なものとみなされれば、感染性廃棄物として、「廃棄物処理法に基づく感染性廃棄物処理マニュアル」に従い、他の廃棄物と分別し適切な容器を使用することになります。また、チメロサールを含むワクチンでは、水銀物質についての基準がありますので、許可業者に情報(種類、量、性状など)を提供し、適切な処理を委託することになります。シリンジ製剤は、注射筒内に血液の逆流の可能性があることから、感染性廃棄物として処理することが適切であると考えられます。また、針刺し事故防止の点から、リキャップせずにただちに針廃棄容器に廃棄してください。
使用後のバイアル製剤・シリンジ製剤の廃棄について アステラスメディカルネット
まとめ
今回は、フルミスト点鼻液の特徴について、注射型のインフルエンザHAワクチンと比較しながら解説しました。最大のメリットは簡便に投与できる点!特に、接種に伴う痛みが懸念される小児には有用ですよね。あと、1回の投与で済むのもポイントだと思います。一方で、フルミストも万能ではありません。生ワクチンの特性や安全性、添加物、水平伝播のリスク等から、従来のインフルエンザHAワクチンの方が望ましいケースもあるからです。フルミスト点鼻液発売後の使用動向に注目していきたいと思います。小児患者では選択されるケースがかなり増えそうな印象ですね。